ScienceBits
Lente Gábor blogja
Az atomtömegek rövid története
MAGYAR KÉMIKUSOK LAPJA
2019. május 20-án az SI mértékegységrendszerben megváltozott a kilogramm alapegység definíciója. Noha általában az anyagmennyiséget és a mól alapegységet szokás úgy emlegetni, mint az SI rendszer vegyészek számára legfontosabb részét, a tömegmérésnek és a reakciókban a tömegek között fellelhető összefüggéseknek döntő szerepe volt a kémia önálló tudománnyá való fejlődésében. 2019 az Egyesült Nemzetek Szervezetének döntése alapján az Elemek Periódusos Rendszerének Nemzetközi Éve, így megemlékezve arról, hogy Dmitrij Ivanovics Mengyelejev (1834-1907) 150 éve, 1869-ben publikálta első periódusos rendszerét. Ebben az elemeket az atomtömegek sorrendjében sorolta föl, így érdemes áttekinteni, milyen fejlődés tette lehetővé munkáját.
A pontos tömegmérés bevezetése alapvető jelentőségű volt a kémiatudományban, ennek széles körű elterjedését a 18. század második felére szokás tenni. A mai megfogalmazásban tömegről beszélünk és már az iskolai kémia- és fizikaórákon is próbálunk mindenkit leszoktatni a súly szó használatáról, de történetileg súlymérésről, illetve atomsúlyokról sokkal indokoltabb beszélni. Természetesen a két mennyiség a Föld felszínén szigorúan arányos egymással, így a hétköznapi felhasználásokban mindegy, melyiket mérjük. Ez a cikk általában a tömeg fogalmat használja majd ott is, ahol ez igazából történetileg nem lenne indokolt. Ha kritikusan tekintjük át a mai mérési módszereket, azt láthatjuk, hogy szinte mindig a súlyt határozzuk meg valahogy, s abból következtetünk a tömegre, így a súly fogalmának tudományos használata sem feltétlenül annyira elítélendő, mint azt a mai magyar iskolai gyakorlat teszi.
A 18. században felhalmozódó tömegmérési adatok lehetővé tették a tömegmegmaradás törvényének kimondását, amely leginkább Mihail Vasziljevics Lomonoszov (1711-1765) orosz és Antoine Laurent de Lavoisier (1743-1794) francia tudósok nevéhez köthető. Ehhez szükség volt egy alapvető, mai szemmel nézve egyszerű, de valójában korántsem magától értetődő felfedezésre: a gázoknak is van tömege, s ezeknek a meghatározása is feltétlenül szükséges a kémiai reakciókban. Mi több, jelentős méréstechnikai fejlődésre is szükség volt a gázok tömegének méréséhez: a Föld felszínén a levegőben ugyanis itt már nem hagyható figyelmen kívül a felhajtóerő szerepe, így a tömeg és a súly fogalmának világos elkülönítésére már a kémiai tömegmegmaradás törvényének kísérleti kimondásához is szükség volt. Nem véletlen, hogy ugyanebben a korban fedezték fel a gáztörvényeket is: ezek alapján egy reakcióban elfogyó vagy keletkező gáz tömegét a jóval könnyebben elvégezhető térfogat- és sűrűségmérési adatokból lehetett meghatározni.
A következő lényegi felismerés az állandó tömegviszonyok törvénye volt. Ennek lényege, hogy a kémiai folyamatokban az egymással maradéktalanul reagáló, illetve keletkező anyagok tömegének aránya csak a reakcióra jellemző állandó, amelyet nem lehet befolyásolni a körülmények (hőmérséklet, nyomás, más anyagok jelenléte) megváltoztatásával. Az állandó tömegarányok alapján egyes reakciókban minden anyagnak egyenértéktömeget lehetett tulajdonítani. Mivel mindig arányokról van szó, ezért célszerű volt egy referenciapontot bevezetni: ebben nem volt egységes a korabeli kémikustársadalom. Kezdetben általában olyan ásványi savat használtak referenciaként, amellyel sok különböző anyag is reagált. Ezt a módszert követte Jeremias Benjamin Richter (1762-1807) is, aki talán a legtöbbet foglalkozott az egyenértéktömegek meghatározásával és rendszerezésével.
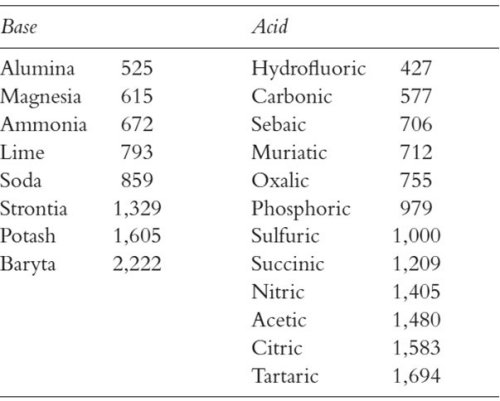
A 19. század elejére már egyértelmű volt, hogy egyazon anyagnak reakciótól függően többféle egyenértéktömege is lehet. John Dalton (1766-1844) érdeme az a felismerés, hogy ezen egyenértéktömegek úgy aránylanak egymáshoz, mint a kis egész számok – ez a többszörös tömegviszonyok törvényeként vált ismertté. A tömeggel kapcsolatos törvények tudományos értelmezése céljából ő vezette be a kémiai atomhipotézist, amellyel egy ókori filozófiai gondolatot, vagyis az anyag tovább oszthatatlan, legkisebb és elpusztíthatatlan egységének létezését mondta ki. A kémiai reakciókban tömegekre felírt törvények mind értelmet nyertek azzal, ha az atomoknak olyan saját tömeget tulajdonított, amely a reakciók során sem változik meg. Mivel egyetlen atom tömegének meghatározása abban az időben reménytelennek tűnt, ezért relatív skálát (vagyis relatív atomtömeget) vezetett be. Viszonyítási alapként logikus választásnak az ismert anyagok közül a legkisebb egyenérték-tömegű, vagyis a hidrogén tűnt. Dalton az egyenértéktömegek alapján elkezdte meghatározni a relatív atomtömegeket, ezek közül mutat be néhányat az alábbi táblázat:
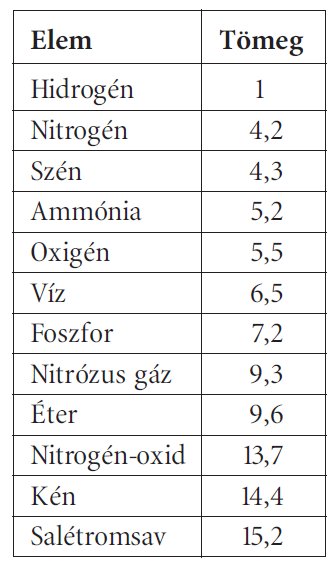
A táblázatban több érdekesség is megfigyelhető: Dalton a vizet és az ammóniát is elemként tüntette fel, noha pontosan tudta, hogy az előbbi hidrogénből és oxigénből, az utóbbi pedig hidrogénből és nitrogénből áll, s ez a tudás az atomtömegek értékében is megjelenik (1 ammónia = 1 nitrogén + 1 hidrogén, illetve 1 víz = 1 hidrogén + 1 oxigén). Az elemek atomtömege nagyon jelentősen eltér a ma megszokott értékektől, de ennek a korabeli mérési adatok pontatlansága csak másodlagos oka, a fő tényező az, hogy a vegyértékeket nem ismerték. Ezen ismeret hiányában Dalton mindig a legegyszerűbb feltételezéshez igyekezett nyúlni: például a víz esetében 1 hidrogén- és 1 oxigénatomot kapcsolt össze. Más vegyületek esetében kevésbé világosak az elképzelések: például se a nitrózus gáz, sem a nitrogén-oxid atomtömege nem kapható meg egész számú nitrogén- és oxigénatom tömegének összeadásával.
Az atomelmélettel közel egy időben született meg két fontos gáztörvény is, amelyek atomtömeg-meghatározásban játszott fontos szerepét csak fél évszázaddal később ismerték el. Az első a vegyülő gázok térfogati törvénye volt, amelyet Joseph Louis Gay-Lussac (1778-1850) írt le elsőként. Azt mondta ki, hogy gázreakciókban az egymással pontosan reagáló, illetve a folyamatban keletkező gázok azonos állapotban mért térfogataránya mindig a kis egész számok arányával adható meg. A második törvény az olasz Amedeo Avogadro (1776-1856) hipotézise volt, amelyet 1811-ben publikált francia nyelven, s a vegyülő gázok térfogatai törvényét értelmezte azzal a Dalton-féle atomelmélet alapján nagyon is kézenfekvő gondolattal, hogy azonos állapotban különböző gázok azonos térfogatai azonos számú részecskét tartalmaznak. Ebből az következett, hogy a gázok kísérletileg könnyen mérhető sűrűsége közvetlen információt ad a bennük lévő részecskék relatív tömegéről. Ez persze kvantitatívan nem volt összeegyeztethető Dalton atomtömegeivel: az oxigén atomtömege e szerint 5,5-szerese a hidrogénének, de a két gáz sűrűségének aránya ennél jóval nagyobb.
A vegyérték fogalmának alapvető jelentőségét az atomtömegek meghatározásában Jöns Jacob Berzelius (1779-1848) svéd kémikus ismerte fel, aki korának vezető szaktekintélye lett. Nagyon aprólékos munkával számos atomtömeget határozott meg, közben néhány új elemet is felfedezett. Annak ellenére, hogy a vegyértékek meghatározása az atomelméletet sokkal összeegyeztethetőbbé tette Avogadro hipotézisével, Berzelius határozottan elutasította ez utóbbit, s ennek alapos oka is volt: a hipotézis még a vegyértékek figyelembe vételével is megkövetelte, hogy azonos atomokból molekulák alakuljanak ki. Akkoriban viszont a kémiai kötést kizárólag elektrosztatikus eredetűnek tartották a belső szerkezet nélküli atomok között: ezzel a képpel semmiképpen nem fért össze az egyforma (vagyis azonos elektrosztatikus tulajdonságú) atomokból álló molekula elképzelése, mert ebben a részek között semmiképpen sem lehetett volna vonzás.
Ennek ellenére Berzelius hozzájárulása a kémia ismeretek fejlődéséhez hatalmas volt: az atomtömegek mérésénél ő vezette be azt a skálát, amelyet utána majdnem másfél évszázadon át használtak. A Dalton által viszonyítási alapnak használt hidrogén ugyanis két szempontból sem volt ideális standard: egyrészt csak kevés elemmel lép reakcióba közvetlenül, másrészt (mint azt manapság már jól értjük) a legtöbb fémmel alkotott vegyülete nem sztöchiometrikus. Az oxigén mindkét szempontból sokkal vonzóbb közvetlen viszonyítási alap volt, így Berzelius erre vonatkoztatta az atomtömegeket (bár eleinte az oxigén tömegét se nem 1-nek, se nem 16-nak vette, hanem 100-nak). Egy általa publikált atomtömegsorozatot mutat be az alábbi ábra:
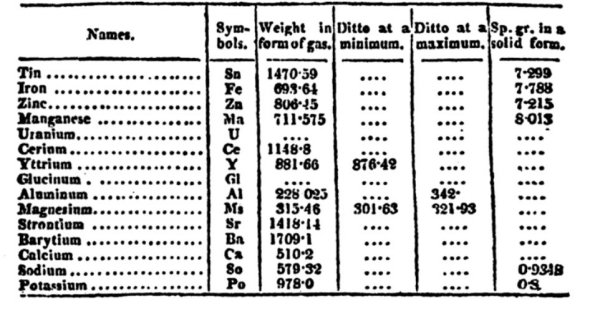
Az Avogadro-törvénnyel majdnem ellentétes pályát járt be William Prout (1785-1850) skót orvos kémiai hipotézise, amelyet 1815-ben publikált. Ez azon a megfigyelésen alapult, hogy az atomtömegek a legtöbb esetben a hidrogén atomtömegének egész számú többszörösei. A hipotézis ezt a jelenséget azzal értelmezte, hogy végső soron minden egyes kémiai elem hidrogénből áll, így ezen elmélet szerint a helyes atomtömegeknek mind egész számoknak kell lenniük; a kémikustársadalom jelentős része és a magyarországi kémiatanítás mind a mai napig lényegében ennek megfelelően áldozza fel a valóságot a könnyű megjegyezhetőség kedvéért. A hipotézist a 19. században a vegyészek jelentős része elfogadta, így Mengyelejev még a 20. század elején is szükségét érezte, hogy a Prout-hipotézissel kapcsolatos súlyos ellenérzéseinek hangot adjon.
Első ránézésre kevés kapcsolata van az atomtömegekkel a Pierre Louis Dulong (1785-1838) és Alexis Thérese Petit (1791-1820) által 1819-ben publikált megfigyelésnek, amelyet ma Dulong–Petit-szabály néven szokás emlegetni. Ma ezt úgy tanítják, hogy a legtöbb fém moláris hőkapacitása azonos. Akkoriban a moláris mennyiségek természetesen még nem léteztek, így az eredeti törvény úgy szólt, hogy egy fém fajhőjének és atomtömegének a szorzata az anyagi minőségtől független állandót ad. Mivel a fajhő könnyen mérhető kísérletileg, ezért ez módot adott a fémek atomtömegének kémiai reakcióktól független megbecslésére, illetve a feltételezett vegyértékek ellenőrzésére. A Dulong–Petit-szabály például szerepet játszott annak bizonyításában, hogy az alkálifémek vegyértéke egy.
A hagyományos sztöchiometriai kísérleteken alapuló atomtömeg-meghatározásokat minden bizonnyal Jean-Servais Stas (1813-1891) belga kémikus végezte el a legnagyobb kitartással és pontossággal. Saját bevallása szerint eredetileg a Prout-hipotézist szerette volna megcáfolhatatlanul igazolni, a pontos kísérletek fényében azonban ezzel ellentétes következtetésre jutott: a Prout-hipotézis nem lehet igaz. Egy 1860-ban megjelent munkájának utolsó lapjáról mutat be egy részletet az alábbi ábra:
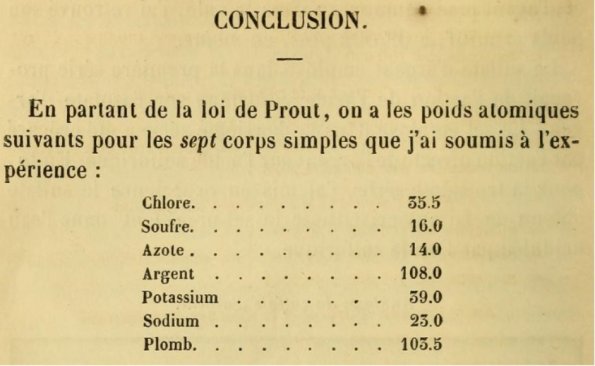
Maga a cikk mintegy 150 oldal terjedelmű, és az atomtömeg-meghatározáshoz elvégzett kísérleteket ismerteti nagy részletességgel. A végkövetkeztetés mindössze hét atomtömeg, ezek a cikkben leírt pontossággal azonosak a ma ismert értékekkel. Az utolsó érték, az ólom (103,5) tükrözi azt, hogy az egyes elemek vegyérték-meghatározása még akkoriban sem volt tökéletes: az ólom mai ismereteink szerint +2-es és +4-es oxidációs állapotban képez vegyületeket. Ezeknek az aránya 2:1, azaz ez alapján nem különböztethető meg attól az esettől, amikor a jellemző oxidációs számok értéke +1 és +2. Egyéb információ hiányában Stas az egyszerűbb lehetőséget, vagyis a kisebb számokat választotta: így az ólom ma ismert atomtömegének felét adta meg – de azt tiszteletre méltó pontossággal.
Az atomtömeg-értékek nagy megújítója Stanislao Cannizzaro (1826-1910) olasz kémikus volt, akinek a nevét ma elsősorban egy szerves kémiai átalakítás miatt szokták megemlíteni egyetemi kémiaórákon. Honfitársa, Avogadro hipotézisét felújítva gázsűrűség-mérési alapokra helyezte az atomtömegek meghatározását. Megmutatta, hogy ezek az értékek ellentmondás-mentesek: minden mért sűrűséget kitűnően tudott értelmezni az általa definiált atomtömegekkel. Egy 1858-ban publikált cikkéből mutat be egy részletet az alábbi ábra:
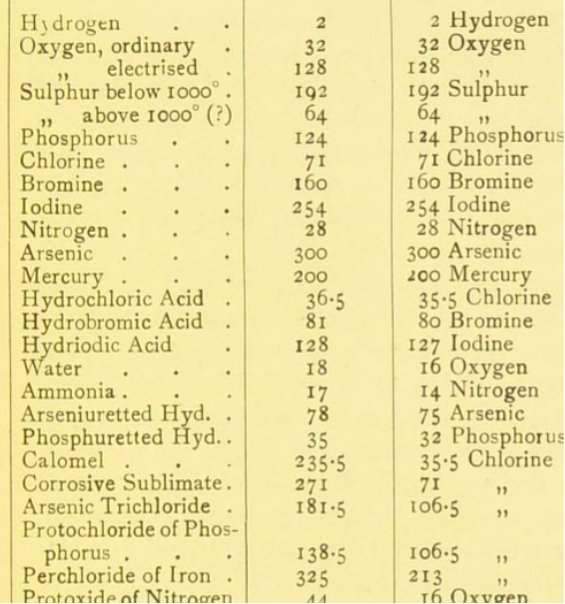
Ahogy látható is, egy elem atomtömegét több, az adott elemet tartalmazó, gázhalmazállapotú vegyület előállításával tesztelte. Cannizzaro munkája és Avogadro törvénye rendezte a vegyértékek kérdését is; ez csak ott maradhatott bizonytalan, ahol az adott elem egyetlen gázhalmazállapotú vegyületét sem sikerült előállítani (ilyenből viszont bizony elég sok akadt).
Cannizzaro remek érzékkel gondoskodott arról, hogy a tudományos közvélemény megismerje és elfogadja érveit s velük együtt az új atomtömegeket. Az első jelentős kémiai konferenciát 1860. szeptember 3. és 5. között szervezte Karlsruhéban Friedrich August Kekulé von Stradonitz (1829-1896) és Charles-Adolphe Wurtz (1817-1884). A konferencia eredeti alapcélja a szerves kémiai képletek felírásmódjának egységesítése volt. Cannizzaro a zárónapon kapott előadási lehetőséget, s mondanivalója hosszú távon igen meggyőzőnek bizonyult. Ezen kívül minden résztvevő kezébe is adta javaslatainak írásos összefoglalóját, amelyet a nagy többség a hosszú, hazafelé tartó úton – egyéb olvasnivaló híján – alaposan át is tanulmányozott. Julius Lothar Meyer (1830-1895) német kémikus – aki Mengyelejevvel megosztva kapta meg az 1882-es Davy-érmet a periódusos rendszer megalkotásáért – a következőt írte erről: „Én szintén megkaptam a cikk egy példányát, amelyet zsebembe tettem, hogy hazafelé elolvassam… Hályog hullott le a szememről, a kétségek megszűntek, és helyét a csendes biztonság érzése fogta el…”. Így 1860-tól Cannizzaro atomtömegei jelentették az egyértelmű hivatkozási alapot.
Az abszolút atomtömegek megbecslésére először 1865-ben Johann Josef Loschmidt (1821-1895) talált módszert. Az ő munkájának elsődleges célja a levegőben lévő molekulák méretének meghatározása volt. Az atomméret a könnyen mérhető sűrűségen keresztül kondenzált fázisban rutinszerűen átszámítható atomtömegre. Gázfázisban már nem ennyire egyszerű a helyzet, de a módszerrel közvetve így is meg lehetett becsülni az 1 g hidrogénben lévő atomok számát: ma ezt Avogadro-állandónak hívjuk, de régebben a Loschmidt-szám is elég elterjedt kifejezés volt.
Így 1869-re sok minden készen állt arra, hogy Mengyelejev – aki egyébként a Cannizzaro-féle atomtömegeket már a karlsruhei konferencia résztvevőjeként megismerte – megalkossa az elemek természetes rendszerét, a periódusos rendszert. Az orosz tudós lényegesen többet tett egyszerű táblázatalkotásnál: a reaktivitásokban fellelhető mintázatok alapján kritikusan újraértékelte az elemek sajátságairól leírtakat, ami az atomtömegekre is hatással volt. A rendszer logikája alapján állapította meg például azt, hogy a berilliumra a korában elfogadott atomtömeg nem lehet helyes, s pusztán logikai érvekkel javasolta a pontos, 9,4-es értéket. Ugyanez volt a helyzet az uránnal: akkoriban két- és három vegyértékűnek tartották ezt a fémet, így az atomtömegre 120 körüli értéket adtak meg. Mengyelejev első próbálkozásaiban még a kis értéket használta, majd a periódusos rendszer alapján jött rá, hogy a helyes vegyértéknek négynek és hatnak, s így az atomtömegnek 240 körülinek kell lennie.
Ezzel nagyjából véget is ért az atomtömegek meghatározásának története. Már csak egy, a számértékekben nagy változást nem hozó módosításra került sor. A 20. század második évtizedében fedezték fel az izotópok létét, s ekkor egy szűk fél évszázadra elváltak a kémia és fizika definíciós útjai. A kémia a természetes izotópeloszlású oxigént (99,76% 16O, 0,04% 17O és 0,20 % 18O) tekintette viszonyítási alapnak, hiszen ezt Berzelius óta így használták. A fizika azonban a tiszta 16O-izotópot tekintette standardnak, mert ettől nagyobb pontosság volt remélhető. A nagy egyesítésre 1960-61-ben került sor: ekkor a 12C-izotóp középpontba helyezésével olyan megoldásban egyeztek meg, ami miatt a nagy pontosságú atomtömegek mind a kémia, mind a fizika számára megváltoztak. Ez a konvenció meglehetősen időt állónak bizonyult: noha 2019. május 20-án a kilogramm és a mól alapegység definíciója is megújult (az anyagmennyiség mértékegysége, a mól pontosan 6,02214076∙1023 darab elemi egységet, pl. atomot, molekulát, iont, elektront vagy más, jól meghatározott részecskét jelent), az atomi tömegegységé változatlan maradt.
![]() 2019.08.01.
2019.08.01.
