ScienceBits
Lente Gábor blogja
A periódusos rendszer megalkotása: az előjelektől a bizonyosságig
DEBRECENI SZEMLE
2019 az Egyesült Nemzetek Szervezete döntése szerint az Elemek Periódusos Rendszerének Nemzetközi Éve lett. A világszervezet így méltó módon emlékezik meg arról, hogy Dmitrij Ivanovics Mengyelejev (1834–1907) orosz kémikus 1869-ben tette közzé először az általa kidolgozott periódusos rendszert, amelyről a tudomány mára bebizonyította, hogy valóban az elemek természetes rendszere. A táblázat azóta a kémiatanulmányok általános érvényű alapjává vált, egyfajta térképpé, amely utat mutat kezdő tanulónak és tapasztalt professzornak egyaránt. Ez az írás a periódusos rendszer megszületésének és széles körű elfogadásának történetéből elevenít fel néhány érdekes mozzanatot. A téma természetesen hatalmas, és ha az olvasó kedvet kapna a benne való részletesebb elmélyedéshez, magyarul (Lacza, 2006) és angolul (Scerri, 2006) is élvezetes stílusú, tudományos szempontból igen igényes könyvek érhetők el.
A periódusos rendszer alapgondolatára érdekes kettősség jellemző. Az egyik az, hogy a körülöttünk lévő világ rendkívüli sokszínűsége ellenére csupán korlátozott számú építőegységből áll, s így ha ügyesek vagyunk, akkor néhány jól kiválasztott alapvető anyagból, vagyis elemből minden más anyagot előállíthatunk. Ezt a gondolatot manapság egy görög filozófusnak, Arisztotelésznek (i.e. 384–322) szokás tulajdonítani, aki meg is nevezte a négy alapelemet: víz, föld, levegő és tűz. Semmi kétség, hogy neki sem sikerült pusztán ebből a négy alapelemből például marhasültet előállítani, de itt elvekről beszélünk: Arisztotelész azt gondolta, hogy ebben az esetben csak annyi a probléma, hogy nincs meg a szükséges tudása az átalakítás sikeres elvégzéséhez.
A másik, ugyanennyire fontos elv az, hogy az érzékszerveink számára folytonosnak tűnő anyag valójában parányi részecskékből áll, így van olyan legkisebb egysége, amely már nem osztható tovább. Ezt a felismerést is egy görög filozófusnak, nevezetesen Démokritosznak (i.e. kb. 460–370) tulajdonítják. Ő a legkisebb egységet saját nyelvének 'oszthatatlan' jelentésű szava (atomosz) után atomnak nevezte. Az eredeti elgondolás szerint minden tiszta anyagnak saját atomjai vannak: a mészkőnek mészkőatomjai, az aranynak aranyatomjai. Ezt az elképzelést később ugyan finomítani kellett, de az alapelv, vagyis az anyag nem folytonos természete (modern fogalommal élve: kvantáltsága) látványosan újjáéledt a kémiatudomány születésekor. Ne zavarjon senkit, hogy az atomokat szabad szemmel nem látjuk: a tudományos fejlődés egyértelműen igazolta, hogy a szemünk által érzékelt fénysugárzással még a legtökéletesebb mikroszkópokkal sem lehet róluk képet alkotni.
Arisztotelész nagy hatású filozófus volt. Kis túlzással azt is lehet mondani, hogy a sötét (?) középkor Európájában tudománnyal foglalkozni alig jelentett többet, mint Arisztotelész műveit olvasni. Így az elemfogalom a mindennapos gondolkodás része maradt, míg Démokritoszra és atomelméletére jó időre a feledés homálya borult. Az alapelemek és tulajdonságaik tanulmányozása azonban sok kíváncsi embernek jelentett mindennapi intellektuális elfoglaltságot. Persze nem a kíváncsiság volt az egyetlen ösztönző erő: az alkimisták például aranyat akartak előállítani. Ha minden a négy alapelemből áll, akkor az arany is, vagyis a megfelelő módszerrel éppen kellő mennyiségű vizet, földet, levegőt és tüzet összegyúrva akár arany is előállítható lenne. Nem az alapanyag hiányzik, gondolták, hanem a tudás: ennek jelképesen a bölcsek köve nevet adták. Volt, akinek ez konkrét, fizikailag létező tárgyat jelentett, volt, akinek megfelelő varázsigék elmormolását. Az ún. jatrokémikusokat is érdekelte az anyagok átalakítása, de itt a meggazdagodás nem volt ennyire közvetlen cél: elsősorban hatásos gyógyszereket szerettek volna előállítani.
Az évszázadok során sok-sok megfigyelés gyűlt össze, amely ellentmondott Arisztotelész elemelméletének. Földből például annyi különfélét ismertek meg, hogy még számon tartani sem lehetett őket könnyen. A vizet – akár folyókból, patakokból vagy tengerből vették – soha nem sikerült úgy elpárologtatni, hogy legalább egy kis föld ne maradjon vissza utána. A levegő egyes típusai büdösek voltak, mások nem, bizonyos fajtái pedig az élőlények gyors halálát okozták. A tűz pedig még az eddigieknél is rejtélyesebb tulajdonságokat mutatott: időnként a semmiből keletkezett, néha pedig nyomtalanul eltűnt. Tévedett volna a nagy görög filozófus?
Végül is az látszott a megoldásnak, hogy Arisztotelész tévedett ugyan, de nem nagyot. Igaza volt abban, hogy léteznek alapelemek, de rosszul nevezte meg őket. Robert Boyle (1627–1691) talán az első kémikus volt, aki rendszerekben gondolkodva végzett kísérleteket, neki szokás tulajdonítani a modern elemfogalom megalkotását is: elem az az anyag, amely más anyagokra semmilyen módszerrel nem bontható. Így a tengervízről be lehetett bizonyítani, hogy nem elem, mert elpárologtatva só maradt utána vissza, a távozó gőzt újra lecsapva pedig újra egy vízhez nagyon hasonló folyadék keletkezett, vagyis két markánsan különböző anyagot sikerült belőle előállítani. De még az ebben a kísérletben keletkező folyadék (mai szavainkkal desztillált víz) sem bizonyult elemnek, mert elektromos áram hatására két különböző gáz keletkezett belőle. Az arany viszont elemnek tűnt: bármit is csináltak vele, soha nem sikerült más anyag hozzáadása nélkül alkotórészekre bontani (bár az is gyanítható, hogy ez az átalakítás kevesek vágyott célja volt csupán). Ugyanakkor az elemek azonosításánál mindig maradt egy bizonytalansági tényező. Ha egy anyagot sikerül alkotórészekre bontani, akkor világos, hogy az nem elem. Viszont hogyan lehet megbizonyosodni arról, hogy egy anyagot semmilyen módon nem lehet másokra bontani? Mindig maradhat ilyenkor kétely: lehet, hogy csak annyi történt, hogy a kísérletező nem találta meg ennek a helyes módját.
A 18. század első felét még semmiképpen nem tartja a történetírás az önálló kémiatudomány korszakának, pedig ekkor két lényeges előrelépés is történt: egyrészt elkezdtek pontos méréseket végezni a kémiai reakciókban, mindenek előtt a reagáló és képződő anyagok tömegét mérték. Másrészt felismerték, hogy a gázok is teljes értékű anyagok, tehát tömegük is van. Ez a két újdonság együtt már elegendő volt ahhoz, hogy többen is megállapítsák a tömegmegmaradás törvényét, amely szerint kémiai reakciókban a reagáló anyagok együttes tömege megegyezik a keletkező anyagok együttes tömegével. A több felfedező közül leggyakrabban Mihail Vasziljevics Lomonoszov (1711–1765) orosz és Antoine-Laurent de Lavoisier (1743–1794) francia tudós nevét szokták említeni.
A gázok tömegének figyelembe vétele nélkül a legtöbb égés ellentmondani látszott a tömegmegmaradás törvényének. Ha fát égettek, akkor a visszamaradó hamu tömege még csak meg sem közelítette az eredeti fa tömegét. Ha vasat égettek (nem könnyű rájönni, hogyan kell, de lehetséges), akkor viszont az égés során keletkező szilárd anyag tömege lényegesen meghaladta a kiindulási fém tömegét. A kulcs itt a reakcióban elfogyó és keletkező gázok tömegének figyelembe vétele volt. Az égések az elemek azonosítása szempontjából is komoly problémát okoztak ebben az időben: nagyon különböző anyagokat is sikerült elégetni, maga az égés folyamata viszont mindig igencsak hasonló volt. Egy rendszerező gondolkodó számára mindebből kézenfekvőnek tűnt, hogy az éghető anyagok összetételében is kell lennie valamiféle közös dolognak. A 18. században ezt a közös dolgot sokan egy elemnek gondolták, amelyet flogisztonnak neveztek el. A flogisztonelméletről gyakran tankönyvek is megemlékeznek, de sajnos ezek ritkán teszik világossá, hogy ennek az elméletnek a megalkotása és a megcáfolása is monumentális intellektuális teljesítmény volt, s nagyon jó példa a tudomány működési módjára, amely során egyre újabb megfigyelések és kísérletek eredményei alapján elfogadunk, módosítunk vagy akár teljesen elvetünk bizonyos elméleteket. És persze arra is jó példa, hogy a folyamat mennyire lassú.
A flogisztonnal kapcsolatos hosszas tudományos vita végeredménye az lett, hogy az égésekben a közös vonás mégsem az éghető anyagokban keresendő, hanem az égést tápláló közegben. Ezt a közös anyagot a már említett Lavoisier-nak sikerült kémiai elemként azonosítania, s történelmi tévedéssel el is nevezte oxigénnek: a szó görög eredetiben savképző elemet jelent, noha – mint később világossá vált – a savakban valójában a hidrogén a közös elem, amelynek a neve egyébként vízképzőt jelent (amit manapság sem tart senki tévedésnek).
A pontos tömegméréseknek volt még egy nagyon fontos hozadéka: érdekes számszerű összefüggéseket lehetett felfedezni az egymással pontosan reagáló anyagok tömegei között. Például 1 gramm hidrogént mindig 8 gramm oxigén segítségével lehetett vízzé alakítani, 1 gramm hidrogén 20 gramm kalcium-mal alkotott óvatosan kezelendő, még a vízzel is hevesen reagáló kristályos anyagot, 8 gramm oxigén pedig éppen 20 gramm kalciummal képzett fehér színű port, amely szintén elég hevesen reagált a vízzel. A sok-sok ilyen megfigyelés könnyen megmagyarázható volt azt feltételezve, hogy minden anyagnak van szabott tömegű mennyisége, amely hidrogénnel reagál, és ez a szabott tömeg a hidrogéntől eltérő elemekkel való reakciókban is lényegi szerepet játszik. 1808-ban John Dalton (1766–1844) meglátta, hogy az atomelmélet segítségével minden értelmet kap: az imént említett szabott tömeg az atomok tömegével van szoros kapcsolatban, a tömegmegmaradás törvénye pedig azért érvényes, mert atomokat nem lehet létrehozni vagy megsemmisíteni, csak a közöttük lévő kapcsolódási módokat lehet megváltoztatni. Ezzel a két ókori filozófus, Arisztotelész és Démokritosz gondolatvilága találkozott: az elemeket az teszi elemmé, hogy bennük csak egyfajta atom van.
Ezután két lényeges, de egymástól korántsem független úton haladt tovább az a fejlődés, amelyről később kiderült, hogy a periódusos rendszer kidolgozásának irányába mutatott. Az egyik ilyen irány az egyes atomok tömegének meghatározása volt. Ebben egy svéd kémikus, Jöns Jacob Berzelius (1779–1848) játszotta a központi szerepet. Szorgos, aprólékos, figyelmes és minden bizonnyal borzasztóan unalmas munkával gyakorlatilag az összes akkor ismert elem atomjainak relatív (vagyis hidrogénre vonatkoztatott) tömegét meghatározták, persze nem mindig hibák nélkül. A svéd tudós neve mellé azt is feljegyezte a történetírás, hogy megalkotta a vegyjeleket. A korábbi kémiai szakirodalomban az elemek, illetve atomjaik jele általában valamilyen kis méretű, grafikus ábra volt. Kis túlzással azt is lehet mondani, hogy annyi jelrendszer létezett, ahány kémikus. Berzelius sokat tett a jelek egységesítéséért. Az is egy remek meglátása volt, hogy a jeleknek olyasmiknek kell lenniük, amelyeket a korabeli nyomdaipar is könnyen tud kezelni: tehát betűknek. Bár a latin már nem volt a tudomány általános nyelve akkoriban (a kémián belül a francia volt a leggyakoribb), a művelt emberek mind olvastak latinul, így a vegyjelek a latin elemnevekből születtek. Már akkoriban is több elem volt ismeretes, mint a latin ábécében a betűk száma, így a vegyjelek egy része kétbetűs lett: az egy- és kétbetűs jelek összekeverését pedig a legkönnyebben úgy lehetett megelőzni, ha a kétbetűs vegyjelekben az első betű nagy, a második kicsi.
A másik út új elemek felfedezése, illetve elemi voltának bizonyítása volt. Itt 1859-ben ugrásszerű előrelépést jelentett az atomspektroszkópia módszerének megalkotása, amelyet Robert Wilhelm Eberhard Bunsen (1811–1899) és Gustav Robert Kirchoff (1824–1887) heidelbergi tudósok nevéhez szokás kötni. Ennek használata lehetővé tette bármely mintában egy-egy elem jelenlétének egyértelmű bizonyítását, így közvetett módon egyes anyagok elemként való azonosítását is. Minden elemhez néhány tucat, mindig megjelenő és csak rá jellemző spektrumvonal tartozik: ha egy mintában csak ismert elemek spektrumvonalai jelennek meg, akkor az nem is tartalmazhat ismeretlen elemet; ha pedig ismert elemhez nem rendelhető spektrumvonal látható egy minta elemzésekor, abban új, még fel nem fedezett elem van.
Ez a módszer szinte egy csapásra rendet tett az elemek azonosítása terén: szűk tíz évvel később Mengyelejevnek már aligha volt kétsége afelől, melyik anyag elem és melyik nem az. Első táblázatában egyetlen olyan "elem" található csak, amely a későbbi idők próbáját nem állta ki, ez a didímium (Di). Mint később kiderült, a didímium spektrumvonalait valójában nem egy, hanem két elem okozta együttesen: ezek az elemek később a neodímium és a prazeodímium nevet kapták. Mengyelejev első kézből tanulhatta meg a spektroszkópia módszerét: 1859 és 1861 között ugyanis éppen Heidelbergben volt tanulmányúton. Ez jó alkalom volt az orosz tudós számára arra is, hogy a nemzetközi kémiakutatás ismert alakjává váljon; például 1860 szeptemberében részt vett az első nagyszabású kémiai konferencián Karlsruhéban. Ez is jelzi, hogy 19. század közepére már a német tudósoké volt a vezető szerep a kémia világában, s a kémia nyelve is a német lett.
Sokat szoktak írni Mengyelejev személyes zsenialitásáról, de a valóságtól az a vélemény sem állhat messze, hogy 1869-re a tudomány fejlődése előkészítette a periódusos rendszer megalkotását: ha Mengyelejevet valami miatt nem foglalkoztatta volna ez a kérdés, akkor néhány éven belül megtette volna más a felismerést. Az atomtömegek már ismertek voltak, így könnyedén sorba lehetett állítani az elemeket, illetve abban is meglehetősen biztosak lehettek, hogy melyek a rendezendő elemek. Viszont az is felettébb valószínűnek tűnt, hogy még nem fedezték fel az összes elemet, s a jövőben újakat is meg fognak ismerni: a rendszeralkotás fő akadálya ez a tény volt. Noha az elemek kémiai tulajdonságainak hasonlóságát már korábban is sokan felismerték, Mengyelejev ezen hiányzó tudás kérdését képes volt úgy kezelni, ahogy előtte senki.
Érdekes módon a szakirodalom számon tartja a periódusos rendszer megalkotásának pontos napját is: 1869. február 17., 9 nappal az alkotó 35. születésnapja után. Akkoriban Oroszországban még a Julián-naptárt használták, így Európa nagy részén március 1-et írtak. Mengyelejev ekkor már több hónapja egy bevezető kémiai tankönyvön dolgozott, s ehhez kereste az ismert elemek logikus tárgyalási módját. Persze kora tudományos irodalmát is jól ismerte, így volt mire támaszkodnia. A leveleiben megőrzött visszaemlékezései szerint aznap megvilágosodásszerű új ötletei támadtak, s minden a helyére került. Ez az élmény nagyon intenzív lehetett, mert ettől a naptól kezdve igen erősen hitt abban, hogy az elemek természetes rendszerét találta meg, és nem csak valami másodrendű, oktatási feladatokat segítő táblázatot állított össze. Így az újonnan megalkotott periódusos rendszer nemcsak az általa használt tankönyvbe került be, hanem még abban az évben először egy orosz nyelvű, majd egy rövidebb, s végül egy részletesebb német nyelvű tudományos cikkben is ismertette a felfe-dezést (Mengyelejev, 1869). Az egyik német nyelvű változat látható az alábbi ábrán.
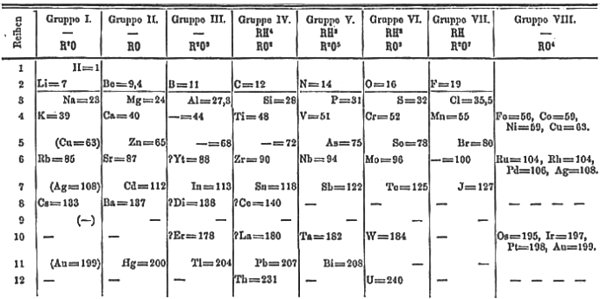
Ez egy mai, nem szakértő olvasó szemével nézve aligha hasonlít arra a táblázatra, amely minden magára valamit is adó kémiaterem falán megtalálható, de valójában ma sem halt ki még teljesen, rövid periódusos rendszerként szoktak hivatkozni rá. Az alapelv az, hogy az elemeket az atomtömegek sorrendjében kell felsorolni, s így a jellemző kémiai tulajdonságok periodikusan visszatérnek: ezt periódusos törvény néven szokás említeni manapság. A táblázat elrendezése olyan, hogy az egymáshoz hasonló elemek egymás fölött-alatt helyezkednek el, s így egy oszlopot (a kémikusok szóhasználatával: csoportot) alkotnak.
A rendezés alapja tehát az atomtömeg lett. Volt viszont egy jelenség, ami miatt az atomtömegek megállapításánál könnyű volt tévedni: a vegyértékek körüli bizonytalanság. A vegyérték lényegében azt mutatja meg, hogy az adott elem hány hidrogénatommal hajlamos vegyületet képezni. Például 8 gramm oxigén 1 gramm hidrogénnel reagál, amiből az oxigén 16-os atomtömege miatt az következik, hogy az oxigén vegyértéke kettő. Sok esetben egy elem hidrogénnel nem reagál valami készségesen, viszont oxigénnel igen: ezért a vegyértékeket többnyire az oxigénen át határozták meg. Azonban az atomtömegek meghatározására alkalmas adat a legtöbbször éppen az egymással maradék nélkül reagáló anyagok tömege volt, vagyis a számítás elvégzéséhez a vegyértékeket más forrásból kellett ismerni. Ez viszonylag könnyű feladat volt, ha elő lehetett állítani az adott elem legalább egy gázhalmazállapotú vegyületét. Ha viszont ez nem teljesült (és ez az elemek jelentős részére így volt), akkor a vegyértéket csak találgatni lehetett.
Az urán esetében ismert volt például, hogy 120 grammja 16 gramm oxigénnel és 24 gramm oxigénnel is stabil vegyületet alkot. Ez nem volt szokatlan, például a vas vegyértéke lehet kettő és három is. Akkoriban ugyanezt gondolták az uránról is, ezért atomtömegét széles körben 120-nak fogadták el. Így viszont az ón és az antimon közé került volna a periódusos rendszerben, vagyis nem olyan helyre, ahol fölötte vagy alatta hasonló elemek lettek volna; arról nem is beszélve, hogy az ón és az antimon között nem is volt oszlop!
Mengyelejev végül is úgy oldotta meg a kérdést, hogy azt feltételezte, hogy az uránnak valójában a két jellemző vegyértéke négy és hat, s így az atomtömege 240, amelyet már egy hozzá valóban hasonló elem, a volfrám alá lehetett besorolni. Hasonló, vegyértékekkel kapcsolatos hibát feltételezve a berillium atomtömegét az akkoriban elfogadott 14 helyett 9,4-re módosította. Ezen feltételezéseket az utókor fényesen igazolta. A berillium példája mutatja azt is, hogy Mengyelejev az atomtömegeket nem gondolta feltétlenül egész számoknak: a klór esetében is 35,5-öt írt a táblázatba.
Volt azonban kellemetlenebb probléma is. Teljesen világos, hogy a kémia tulajdonságok hasonlósága miatt a jódot a bróm, a tellúrt pedig a szelén alá kellene írni, de a tellúr atomtömege (127,6) mégis egy kicsit nagyobb volt a jódénál (127). Itt Mengyelejev a valóságot próbálta meg hozzáigazítani a saját elméletéhez: azt gondolta, hogy a tellúr atomtömegét hibásan határozták meg, annak 125-nek kell lennie. Az utókor itt a periódusos rendszerben való elhelyezésben maximálisan igazat adott az orosz tudósnak, de az atomtömeget illetően már nem. Ugyanilyen gondot okozhatott volna, ha 1869-ben pontosabban ismerték volna a kobalt (58,9) és a nikkel (58,7) atomtömegét. Itt viszont a kor ismeretei alapján Mengyelejev joggal helyezte mindkét elemet 59-es atomtömeggel a rendszerbe, a sorrendre pedig a kémiai tulajdonságokból helyesen következtetett. A modern peridusos rendszerben az atomtömegekben a legnagyobb visszafordulás az argon (40) és a kálium (39) között van. A sors ettől a problémától Mengyelejevet kegyesen megkímélte: az argont csak 25 évvel később fedezték fel.
Az 1. ábrán több helyen is látni olyan mezőket, amelyek vegyjelet nem tartalmaznak, de atomtömeget igen. Ilyen például a cink után található "- = 68" és "- = 72" bejegyzés. Ahogy volt már róla szó, 1869-ben mindenki egészen biztos lehetett abban, hogy még nem fedezték fel az összes elemet. Az atomtömegek sorrendje alapján a cink (65) után az arzén (75) következett. Az arzén helye a kémiai tulajdonságai alapján viszont egyértelműen a foszfor, és nem az alumínium alatt volt. Így aztán Mengyelejev arra a belátásra jutott, hogy a cink és az arzén között még két, addig fel nem fedezett elemnek kell lennie. Ezeknek nemcsak helyet hagyott a táblázatban, hanem későbbi munkája során a fizikai és kémiai tulajdonságaikat is megjósolta. Ideiglenes nevet mindegyiknek a fölötte lévő elem nevének kiegészítésével adott: a "- = 68"-at ekaalumíniumként, a "- = 72"-t pedig ekaszilíciumként említette. Az előbbit már 1875-ben fel is fedezték, az utóbbi 1886-ig váratott magára. Mindkettőt a felfedező hazájáról nevezték el: az ekaalumíniumot Franciaországról galliumnak, az ekaszilíciumot Németországról germániumnak. Így alakult, hogy a két nagyhatalom nemcsak a valóságban, hanem a periódusos rendszerben is egymás szomszédja lett, ráadásul Franciaország ott is nyugatra van Németországtól. A gallium és germánium kísérletileg meghatározott tulajdonságai fényesen igazolták Mengyelejev jóslatait!
A többi jóslat már korántsem volt ennyire egyértelmű siker. A feljegyzések szerint Mengyelejev összesen 16 új elem felfedezését jósolta meg, amiből nyolc tévesnek bizonyult (Kovács et al., 2011, 2014). A fő probléma az volt, hogy nem tudott mit kezdeni a ritkaföldfémekkel: ezekből 1869-ben még csak négy volt ismert, de a következő évtizedekben még jónéhányat felfedeztek belőlük. Atomtömegeik egymás mellé sorolta be őket a rendszerbe, kémiai sajátságaik viszont annyira hasonlítottak, hogy még elválasztani is nehéz volt egymástól őket. Ezért könnyen félrevezették az egy csoporton belüli hasonlóságokon alapuló elemjóslatokat.
1894-ben még súlyosabb probléma akadt: ebben az évben fedezték fel a levegőben az argont, amely elsőre sehogy sem illett bele a periódusos rendszerbe. Az atomtömege majdnem pontosan meggyezett a kalciuméval, de a kémiai sajátságai egyetlen korábbról ismert elemére sem hasonlítottak. Mengyelejev először az egyértelmű spektroszkópiai adatoknak sem akart hinni: azt gondolta, hogy valójában nem is új elemről, hanem a nitrogén háromatomos módosulatáról van szó. Aztán a következő szűk öt év alatt még négy hasonló elemet fedez-tek fel: a héliumot, a neont, a kriptont és a xenont. És csodák csodája, az atomtömegek is úgy jöttek ki, hogy – az argon kivételével – mind egy-egy alkálifém előtt következett a listában. Így könnyű volt megtalálni a megoldást: felfedezték a periódusos rendszer egy korábban ismeretlen csoportját, a nemesgázokat. 1869-ben ezek létezését képtelenség volt megjósolni, mert a jóslatok a csoporthasonlóságokon alapultak, ebből a csoportból viszont egyetlen elem sem volt akkor még ismert. Így lett tehát a periódusos törvényt eleinte megcáfolni látszó felfedezésből a periódusos rendszer legfényesebb diadala.
Mengyelejev 1904-ben publikálta utolsó periódusos rendszerét, ez látható a következő ábrán. Ebben már az addig felfedezett új elemek és a nemesgázok csoportja is szerepel. Az is látható, hogy Mengyelejev még az egyre inkább felhalmozódó kísérleti tapasztalatok ellenében is ragaszkodott ahhoz a nézetéhez, hogy az elemeknek az atomtömegek sorrendjében kell szerepelniük. A tellúr esetében annyi engedményre hajlandó volt, hogy a jóddal azonos (127) atomtömeget írt mellé, de az argont a kísérletileg ismert 40-es érték helyett 38-cal tüntette fel, hogy a kálium elé kerüljön.
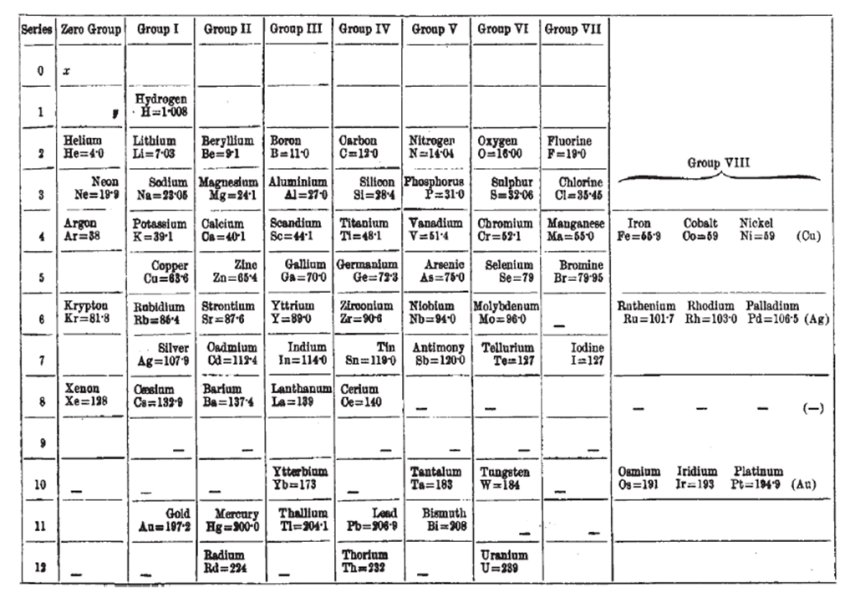
Ebben a periódusos rendszerben van még egy érdekesség: a nemesgázok felfedezése új jóslatokra ihlette az orosz tudóst. Ebbe az oszlopba két, a hidrogénnél könnyebb, de még felfedezetlen elemet is feltüntetett x és y jelekkel. Az x elemet a fizikusok által akkor létezőnek gondolt éter megfelelőjének hitte, az y jelölésű elemet pedig több néven is említette munkáiban, ezek közül a leggyakoribb a korónium volt. 1904-ben még egy évtized sem telt el az argon felfedezése óta, ezért Mengyelejev joggal gondolhatta, hogy lehet még addig isme-retlen nemesgáz, amely esetleg a Földön nem is fordul elő. Ezen kívül egy sokkal filozofikusabb jellegű oka is volt az x és y feltételezésre. Akkoriban sokan elfogadtak egy Prout-hipotézis nevű elméletet, amely azt mondta ki, hogy minden egyes atom valamilyen módon végső soron hidrogénatomokból áll. Ebből persze az következett, hogy nem lehetséges a hidrogénnél könnyebb atomot elképzelni. Mengyelejev viszont ádáz ellensége volt ennek a hipotézisnek, mellyel szembeni ellenérzését azzal is kinyilvánította, hogy az x és y elemek jóslataihoz élete végéig ragaszkodott.
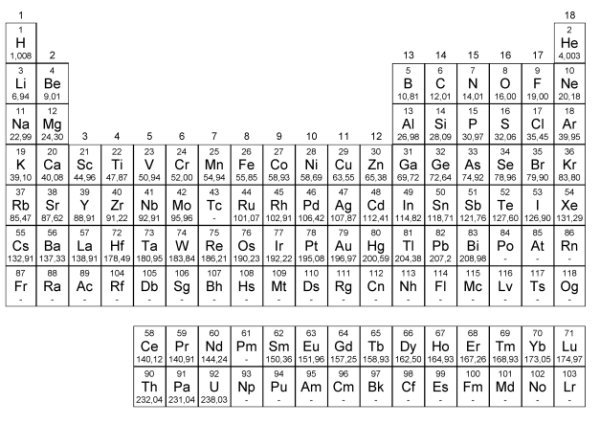
1905-ben kezdett elterjedni a periódusos rendszer ma szokásos, nyújtott felírási módja, amelyben 18 oszlop szerepel. Ez látható az utolsó ábrán az összes ma (tehát 2019 elején) ismert elem feltüntetésével. Ennek a népszerűsítésében Alfred Werner (1866–1919) svájci kémikus játszott főszerepet, bár nem ő alkotta meg: Mengyelejev is ismerte ezt a felírásmódot, de nem kedvelte különöseb-ben. Werner egyébként a koordinációs kémia megalapozásáért 1913-ban kémiai Nobel-díjat kapott.
1913 döntő fontosságú év volt a periódusos rendszer történetében, de sajnos ezt Mengyelejev már nem érte meg: hat évvel korábban halt meg úgy, hogy nem kapta meg a legnagyobb tudományos elismerést, a Nobel-díjat (Hargittai, 2019). Ebben az évben Niels Henrik David Bohr (1885–1962) dán tudós közölt egy, azóta gyakran trilógiaként is emlegetett, három cikkből álló közleménysorozatot az atomok elektronszerkezetéről. Ebből világossá vált a periódusos törvény háttere: az egymás alatt lévő elemek hasonlóságát az okozza, hogy a kémiai tulajdonságok kialakításában a vegyértékelektron-héj szerkezete az elsődleges, ez pedig az egymás alatt lévő elemek esetében azonos.
Ugyanebben az évben különböző anyagok és a röntgensugárzás kölcsönhatásának vizsgálata során Henry Gwyn Jeffreys Moseley (1887–1915) angol fizikus is tett egy hatalmas horderejű felismerést, amelyet azóta Moseley-törvényként emlegetnek. E szerint bármely elemhez a röntgenfluoreszcencia-kísérletek során általa kibocsátott sugárzás elemzésével hozzárendelhető egy egész szám, amelyet rendszámnak neveztek el, és azonosnak bizonyult az adott elem atommagjában lévő protonok számával. Ez az egész szám a hidrogénre például 1, a héliumra 2, a szénre 6, az uránra pedig 92.
A Moseley-törvénynek több fontos következménye is volt. Egyrészt tisztázta, hogy a periódusos rendszerben az elemek sorrendje nem az atomtömegeket követi szigorúan, hanem a rendszámokat. Azt is világossá tette, hogy hol van addig ismeretlen elem a periódusos rendszerben: 1913-ban például a 43-as, a 61-es és a 75-ös rendszámú elemek hiányoztak még. Ezek után szisztematikus kutatás indulhatott, s így már sokkal könnyebb volt megtalálni őket. Végül azt is eldöntötte, hogy hol nem lehet ismeretlen elem: a klór és az argon között hiába van váratlanul nagy ugrás az atomtömegben, ott fel nem fedezett elem nincsen, és ugyanígy nem léteznek a hidrogénnél kisebb rendszámú elemek.
1913-ban tehát végképp bebizonyosodott az, amiben Mengyelejev 1869. február 17. óta szilárdan hitt: a periódusos rendszer nem csupán az elemek táblázatszerű felsorolása, hanem az elemek természetes, anyagszerkezeti sajátságokat sok módon tükröző rendszere, amely alapján el lehet igazodni a kémia alapvető összefüggései között. Habár számos különböző formában rajzolják fel manapság is, ezek mögött az alapgondolat mindig közös. Efelől az elmúlt száz évben senkinek nem volt kétsége, s ma sincsen ilyen kétely. Mint ahogy az is egyértelmű, hogy az alapelvek megalkotásához és tudományos körökben való elterjedéséhez Dmitrij Ivanovics Mengyelejev hozzájárulása hatalmas volt: méltóképp ünnepeljük 2019-ben az ő felismerésére emlékezve a periódusos rendszer évét.
![]() 2019.04.30.
2019.04.30.
