ScienceBits
Lente Gábor blogja
Száz éves a Bohr-féle atomelmélet
MAGYAR KÉMIKUSOK LAPJA, VEGYIPAR- ÉS KÉMIATÖRTÉNET
Az 1913-as év második fele fontos mérföldkő volt az atomelméletek fejlődésében: Niels Bohr (1885-1962) dán fizikus ekkor ismertette atomelméletét három hosszú közleményben a Philosophical Magazine folyóirat hatodik sorozatában (Phil. Mag. Ser. 6 1913, 26, pp. 1-25, pp. 476-502, pp. 857-875), illetve egy rövid olvasói levélben a Nature folyóiratban (Nature 1913, 92, pp. 231-232).
Ernest Rutherford (1871-1937) alig néhány évvel korábbi atommodellje a nagy tömegű atommag körül keringő kicsi elektronokat feltételezett, de kvantitatív előrejelzésekre nem volt képes. Emellett néhány alapvető sajátsága is ellentmondott a kísérleti tapasztalatoknak: nem tudta értelmezni az atomspektrumok akkoriban már fél évszázada ismert vonalas szerkezetét, és a klasszikus fizika tanítása szerint a keringő elektronoknak – mint gyorsuló töltéseknek – elektromágneses sugárzás kibocsátása közben folyamatosan energiát kellene veszíteniük.
Niels Bohr ezeket a problémákat posztulátumokkal oldotta meg, amelyek nem következtek a klasszikus fizikából, de az elektronmozgást alapjában véve a dinamika és elektrosztatika jól ismert törvényei segítségével írta le. Az egyik posztulátum a stacionárius állapotok feltételezése volt. E szerint az atomban kötött elektronok csak úgy létezhetnek, hogy mozgás közben nem sugároznak, illetve nem vesztenek energiát. Az atomi spektrumok vonalainak értelmezéséhez Bohr azt feltételezte, hogy ezek a stacionárius állapotok kvantáltak, vagyis energiájuk nem lehet tetszőleges, hanem néhány kiválasztott érték egyikének kell lennie. A kvantáltságot igazából nem is az energia, hanem a pályamozgáshoz tartozó impulzusmomentumok segítségével volt könnyebb megadni, amely csak
A Bohr-féle atomelmélet egyik legnagyobb, azonnali eredménye az volt, hogy a hidrogén atomspektrumának elemzése alapján levezetett Rydberg-állandót (
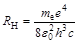
(a képlet a mai SI jelöléseit használja,

Persze az említett három cikkben nem minden gondolatmenet állta ki az idő próbáját: Bohr a vízmolekulát lineáris alkatúnak, a H2+-molekulaiont pedig instabilnak gondolta. A hidrogénatom alapállapotáról az bizonyosodott be, hogy a dán tudós elméletének feltevéseivel szemben az elektronnak nulla a pályaimpulzus-momentuma. Később Arnold Sommerfeld (1868-1951) segítségével az elméletét elliptikus elektronpályák és egy újabb kvantumszám feltételezésével bővítette ki, amivel a modell egy sor jelenség magyarázatára vált képessé, de ezzel eljutott alkalmazhatóságának határáig. Az atomok és molekulák szerkezetének és viselkedésének adekvát leírásában az újabb jelentős előrelépés az Erwin Schrödinger (1887-1961) osztrák fizikus által 1926-ban bevezetett, s később róla elnevezett hullámmechanikai egyenlet és a Werner Heisenberg (1901-1976) német fizikus által ugyanakkor javasolt „mátrixmechanika” kidolgozása volt. A Bohr-féle atomelmélettel szemben az új elmélet nem a korábban megalapozott fizikai összefüggések ad hoc megkötésén, hanem egészen új posztulátumokon alapult. A manapság kvantummechanikának nevezett elmélet nemcsak az elektron mozgásának leírására, hanem gyakorlatilag minden, a mikrorészecskék világában megmérhető tulajdonság helyes jóslására képes, ami az alapjául szolgáló posztulátumok helyességét bizonyítja.
![]() 2013.10.17.
2013.10.17.
